We leven in het postantibioticatijdperk. Dat zegt althans de Wereldgezondheidsorganisatie (WHO). Niet zomaar, want als we niet ingrijpen sterven er tegen 2050 jaarlijks zo’n tien miljoen mensen aan antibioticaresistente bacteriën. Dat zijn er meer dan nu aan kanker. En dus is het koortsachtig zoeken naar alternatieven. UGent-onderzoekers komen alvast met een veelbelovende doorbraak.
Centraal in het onderzoek staan lysines, enzymen die bacteriën vernietigen door de celwand kapot te knippen. In een fractie van een seconde. “Eigenlijk zou je ze kunnen omschrijven als het snelst werkende antibioticum ooit”, zegt professor Yves Briers. Hij leidt de onderzoeksgroep en heeft samen met zijn team een duidelijke missie: lysines tot echte medicijnen maken. Antibiotica op basis van enzymen, ofwel enzybiotica genoemd.
“We hebben een techniek, VersaTile, die het makkelijker kan maken om de stap naar klinische testen te zetten”, klinkt het. Concreet maakt de techniek het mogelijk om razendsnel lysines samen te stellen. Zo kan er op een snelle en efficiënte manier voor iedere mogelijke bacteriële infectie een aangepast lysine of enzybioticum gemaakt worden. Ook voor bacteriën waar traditionele antibiotica niet meer baten. “Lysines hebben het potentieel om een nieuwe generatie van antibiotica te worden”, vertellen onderzoekers Hans Gerstmans en Dennis Grimon, die mee aan de basis liggen van VersaTile.
Wetenschap Uitgedokterd: De nieuwe generatie antibiotica: zo simpel als Lego?
Postantibioticatijdperk
Het is hoogdringend dat zo’n nieuwe generatie antibiotica er komt. Superbacteriën bedreigen letterlijk de hele wereldbevolking. Steeds meer bacteriesoorten ontwikkelen resistentie tegen meerdere of zelfs àlle antibiotica (zie tijdlijn). Zelfs een simpele bronchitis wordt op de duur weer dodelijk. Volgens de WHO zitten we nu al in een postantibioticatijdperk. De laatste cijfers zijn dramatisch: jaarlijks vallen er nu al 33.000 doden in Europa als gevolg van een infectie met resistente bacteriën (bron Europees Centrum voor Ziektepreventie en –bestrijding, ECDC).
Bovendien lijkt het erop dat antibioticaresistentie een rol speelt bij sommige coronadoden. Het coronavirus verzwakt patiënten, waarna secundaire bacteriële infecties in het ziekenhuis de behandeling nog moeilijker maken en de kans op sterfte stijgt. Verder onderzoek is nodig, maar de behoefte aan werkzame antibiotica is ook hier groot.
De perfecte storm
“De strijd tegen bacteriën zijn we momenteel dus aan het verliezen. We staan voor de perfecte storm”, vertelt professor Briers. “Er is al een hoge mate van multidrugresistentie (MDR), dat wil zeggen: bacteriën die tegen meerdere antibiotica bestand zijn. Maar het evolueert steeds meer naar XDR, of extensively drugresistent en zelfs pandrugresistent (PDR).” Anders gezegd: bacteriën die met geen enkel antibioticum nog te behandelen zijn. “De eerste bevestigingen van PDR zijn er al.”
Na de Tweede Wereldoorlog leek er nochtans geen bacteriële infectie te bestaan die antibiotica niet konden bestrijden. Het in 1928 ontdekte penicilline verrichte mirakels bij de vele oorlogsslachtoffers. Wonden die infecteerden en vaak tot de dood leidden, konden plots genezen. De medische wereld raakte verblind door efficiëntie. Patiënten vroegen zelfs antibiotica bij virale infecties zoals verkoudheden, hoewel ze daartegen geen enkel nut hebben. Irrationeel gebruik wakkerde resistentie aan. “Sommige bacteriën hebben genen die ervoor zorgen dat ze beter bestand zijn tegen antibiotica. Bij een onvolledige of foute behandeling, blijven die sterkere bacteriën over en geven ze de ‘betere’ genen door aan de volgende generatie. Die wordt dus iets meer resistent”, legt professor Briers uit.
Last resort
Hoe langer dat proces doorgaat, hoe groter de gevolgen. In 1947 werkte penicilline al niet meer tegen bepaalde bacteriën. Nu, ruim 70 jaar later zijn er volgens professor Briers nog slechts enkele strohalmen over. “De last resort antibiotica. We hebben het hier letterlijk over antibiotica die al jaren enkel in zeer specifieke omstandigheden gebruikt worden als laatste redmiddel.”
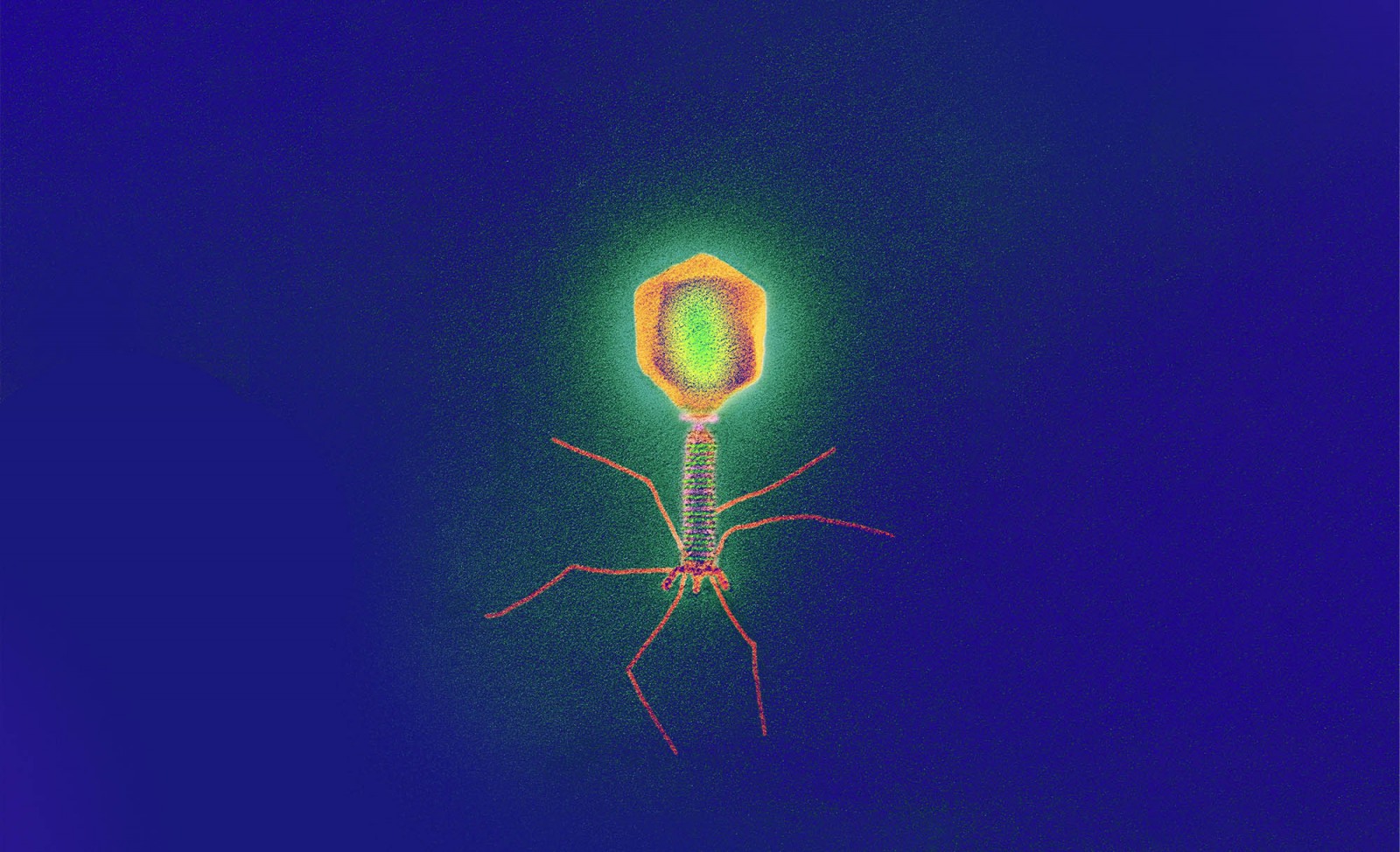
Nochtans bestond er nog voor de ontdekking van penicilline al een veelbelovend alternatief. De Frans-Canadese microbioloog Felix d’Herelle heeft het in 1917 over een onzichtbare microbe, een virus dat parasiteert op bacteriën. Hij gaf hem de naam bacteriofaag, een samentrekking van bacterie en het Griekse phagein, of eten. Bacterie-eters dus.
Aanvankelijk heerste er veel enthousiasme over het medische potentieel van fagen. Een belangrijk nadeel: fagen zijn bacteriestamspecifiek. Eén specifieke faag kan maar enkele specifieke bacteriestammen vernietigen. “De meeste antibiotica werken in vergelijking als een atoombom: ze vallen bijna alle bacteriën aan en zijn op die manier efficiënter en dus gemakkelijker toe te passen. Bovendien was de productie van antibiotica veel makkelijker dan die van bacteriofagen”, verklaart Gerstmans waarom die laatste in de westerse wereld snel weer onder de radar verdwenen.
Schaartjes
Nu de resistentieproblematiek steeds nijpender wordt, komt daar verandering in. De onderzoeksgroep van professor Briers verdiept zich in fagen als mogelijk alternatief voor antibiotica. De belangrijkste piste spitst zich toe op het ultieme wapen dat fagen gebruiken tegen bacteriën: lysines. “Je kan ze voorstellen als schaartjes”, vertelt Gerstmans. “Als bacteriofagen bacteriën aanvallen, dringen ze binnen in de bacterie. Daar vermenigvuldigen ze zich tot de bacterie barstensvol zit. Op het einde van dat proces willen de nieuwe fagen uitbreken en daar komen lysines aan te pas. Zij knippen de celwand van binnenuit kapot, waardoor de bacterie openbarst en de fagen zich verspreiden om andere bacteriën te infecteren.”
Spelen met Lego
Via biotechnologie is het mogelijk om lysines te isoleren en te produceren op grote schaal. “Ze bestaan uit één consistente molecule die werkt op de hele bacteriële soort en dus niet op één stam. Zo zijn ze dus niet zo specifiek als bacteriofagen en voldoen ze wel aan de definitie van een farmaceutisch product”, aldus nog Gerstmans.
Maar het grootste voordeel zit in de ‘manipuleerbaarheid’ van de lysines. Professor Briers: “Ze bestaan uit verschillende componenten, je zou kunnen zeggen blokjes. Ieder blokje draagt iets bij, zoals efficiëntie of snelheid. We hebben gezien dat we met die blokjes kunnen spelen, zoals met Lego. Je kunt ze moduleren door de volgorde te herschikken. Of bijvoorbeeld andere combinaties te maken. Zo kan je de eigenschappen van een lysine veranderen, verbeteren en aanpassen in functie van de behandeling.”
“Op die manier kunnen we ‘banken’ aanleggen van lysines waarvan we weten dat ze werken tegen bepaalde bacteriën. Komt er een patiënt die besmet is met één van die bacteriën, dan is het een kwestie van de juiste variant uit de ‘bank’ te gebruiken.”
Een probleem: dat aanpassen vraagt normaal gezien heel veel tijd. Tot nu.
Doorbraak
“Het unieke aan ons onderzoek is dat we erin geslaagd zijn om die aanpassingen heel snel en op grote schaal door te voeren. Nu kunnen we op enkele dagen tijd miljoenen varianten maken, ook combinaties die niet in de natuur voorkomen. Op slechts een paar dagen tijd is het mogelijk een medicijn op maat te maken”, aldus Dennis Grimon, die vanaf het eerste moment betrokken was bij de ontwikkeling van de nieuwe techniek. Hij heeft het over een mijlpaal. “Het kan een versnelling in het veld betekenen, een accelerator. Maar ook bij behandelingen zal deze techniek een groot nut hebben, net omdat we zo snel kunnen schakelen. Al loopt deze gepersonaliseerde aanpak voor op wat er binnen het huidige regulatorische kader mogelijk is”, benoemt hij de belangrijkste horde waarvoor het lysine-onderzoek nu staat.
Niettemin is het begrip ‘doorbraak’ niet ijdel. Dat bewees het team door een enzybioticum te maken voor de iraqibacterie: een multidrugresistente bacterie die voor heel wat wondinfecties zorgde tijdens de oorlog in Irak. Ondertussen loopt er ook een Amerikaans onderzoek dat het met lysines tot de laatste fase van klinische testen heeft geschopt. “Specifiek voor de behandeling van endocarditis, een infectie van de hartkleppen, en bloedstroominfecties die vaak fataal zijn. De FDA (U.S. Food and Drug Administration) heeft het over een ‘breakthrough therapy’, een label dat ze geven aan nieuwe, veelbelovende behandelingen om het klinisch onderzoek en het goedkeuringsproces te versnellen” onderstreept professor Briers het potentieel van deze enzybiotica.
Goodbye antibiotica?
Is het tijdperk van de antibiotica dan binnenkort voorbij? De onderzoekers klinken resoluut: “Nee. Antibiotica zullen altijd nodig blijven. Vermoedelijk gaan we naar een scenario waarin beide behandelingen naast elkaar bestaan of samen worden gebruikt. Bij veel infecties is er een combinatie van bacteriën. Soms weet je niet tegen welke je precies strijdt en vaak dringt de tijd. Dan is het atoombomeffect van antibiotica nodig. Maar als er iets meer tijd is, kan je perfect nagaan wat er precies speelt en ofwel een bestaande lysine inzetten of er één op maat maken”, aldus Gerstmans. Professor Briers ziet nog een ander element: “Het lijkt erop dat resistentie afneemt als we bacteriën met enzybiotica bestrijden en dus zuiniger omspringen met antibiotica. Bacteriën moeten zich niet meer constant wapenen tegen antibiotica, waardoor ze hun verdediging ook uitschakelen.”
Voor het zover is, valt er nog een lange weg af te leggen. De volgende stap is nu zo veel mogelijk lysines in de pijplijn van de klinische testen te krijgen. Testen die makkelijk meer dan vijf jaar in beslag nemen. Toch heeft professor Briers er een goed oog in: “Bedrijven als Pfizer tonen interesse en starten onderzoeken op. Ik ben zeer hoopvol dat we lysines ooit als therapeutisch product zullen gebruiken.”
En dus lijkt Gerstmans er niet zo gek ver naast te zitten, toen hij het had over “een nieuwe generatie van antibiotica.”
Lees ook
“Elke euro steun is een zetje dat kankeronderzoek vooruitduwt”
In Gent werken honderden onderzoekers aan betere manieren om kanker te voorkomen, op te sporen en te behandelen. Het Cancer Research Institute Ghent (CRIG) brengt hen samen en biedt aan jong onderzoekstalent wat hen vaak het hardst ontbreekt: de kans om te starten. Met dank aan de vele giften aan het CRIG.
Biedt stoelgang een behandeling voor parkinson?
Een recente studie naar de ziekte van Parkinson toont aan dat een stoelgangtransplantatie een waardevolle nieuwe behandeling kan zijn. “Het biedt een potentieel veilige, doeltreffende en kostenefficiënte manier om de symptomen en de levenskwaliteit van miljoenen mensen te verbeteren. Een ‘bacteriepil’ zou de stoelgangtransplantatie misschien wel vervangen. Maar er is meer onderzoek nodig.”
Ignaas Devisch prikkelt al jaren ons denken (en krijgt daar nu erkenning voor)
Twintig jaar geleden werd hij als wetenschapper uitgelachen toen hij wilde communiceren met het grote publiek. Nu krijgt Ignaas Devisch er de Loopbaanprijs Wetenschapscommunicatie voor. “Het is een mooie erkenning”, zegt de medisch filosoof. “Al is communiceren over wetenschap toch ook goed leren luisteren.”
Hoge nood aan testpersonen voor geneesmiddelen of vaccins: “Zonder hen is er geen medische vooruitgang”
“Geen enkel vaccin of geneesmiddel geraakt tot bij de apotheker zonder testpersonen.” Het klinkt bijna banaal, maar het is de essentie van klinisch onderzoek, zegt professor Isabel Leroux-Roels. Zij en haar team doen al jaren onderzoek naar nieuwe vaccins. “Testpersonen vormen een heel belangrijke schakel in ons onderzoek.”