Er is een mogelijke doorbraak in de behandeling van een zeldzame soort tumoren. De zogenoemde desmoïde tumoren, die momenteel niet goed te behandelen zijn. De oplossing ligt mogelijks in een medicijn dat nu ingezet wordt tegen een andere soort kanker. Omdat het medicijn al uitvoerig getest is op een aantal belangrijke zaken zoals dosering en mogelijke bijwerkingen, kan het relatief snel op de markt komen voor mensen met een desmoïde tumor.
“Het is heel uitzonderlijk dat we zo snel van fundamenteel onderzoek naar een klinische fase kunnen”, vertelt professor Kris Vleminckx, die een onderzoeksgroep leidt in het Departement voor Biomedische Moleculaire Biologie dat ook geassocieerd is met het Cancer Research Institute Ghent. “Ja, ik heb wel een sprongetje gemaakt toen ik de resultaten van mijn toenmalige doctoraatsstudent Thomas Naert voor het eerst zag. Het kan grote gevolgen hebben voor mensen met een desmoïde tumor.”
Amputeren soms enige optie
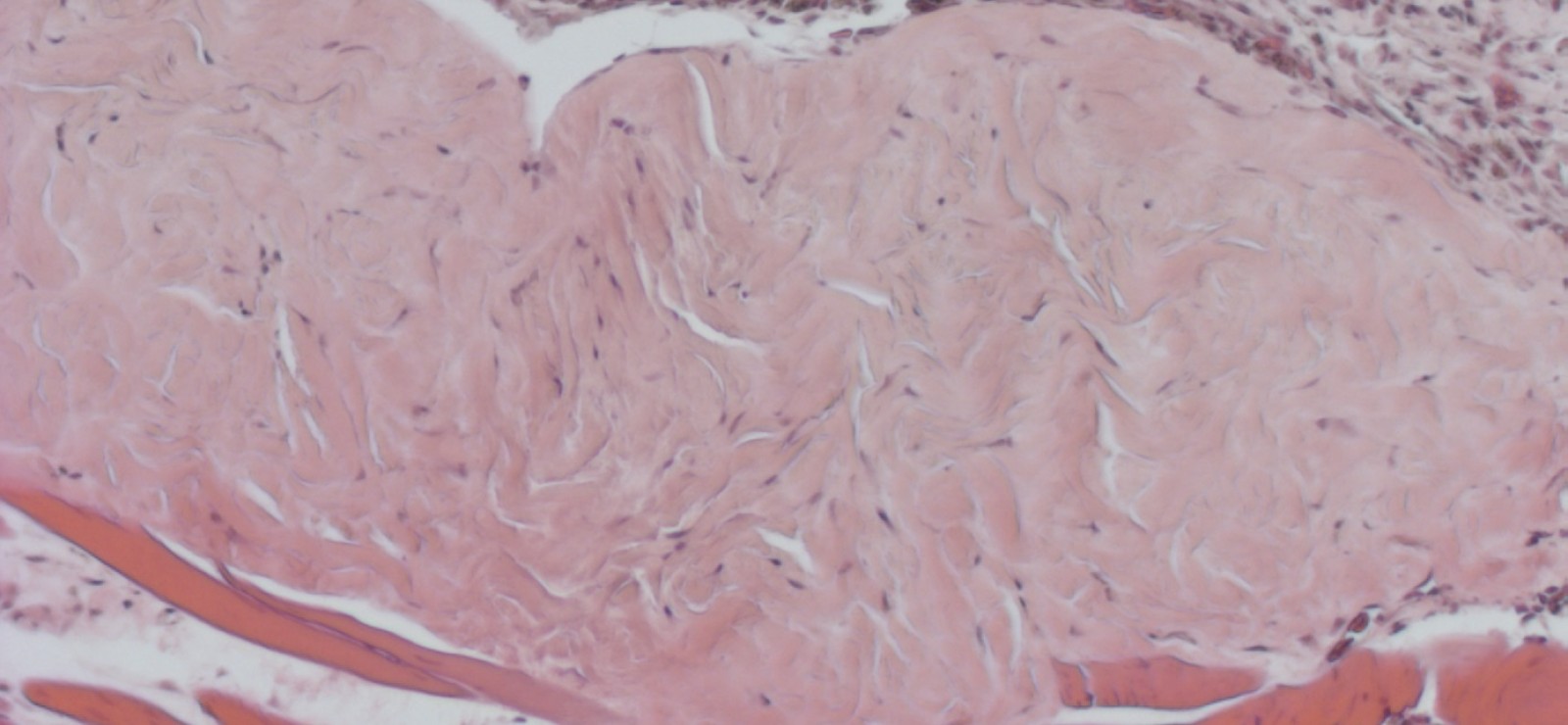
Een desmoïde tumor is zeldzaam en ontstaat in het bindweefsel. Hoewel de tumor normaal gezien niet uitzaait zoals de meeste kankers, kunnen de gevolgen toch groot zijn. Typisch aan de desmoïde tumor is dat die diep indringt in naburige weefsels. Afhankelijk van de plaats waar de tumor ontstaat, kan die zo interfereren met de functie van bepaalde weefsels of organen, en in sommige gevallen zelfs levensbedreigend zijn.
“Omdat de tumor niet uitzaait, gaan dokters er vaak heel conservatief mee om. Operatief kun je hem bijna niet verwijderen, omdat hij heel intens verstrengeld is met het naburige weefsel”, legt professor Vleminckx uit. “Maar heb je bijvoorbeeld een desmoïde tumor in je been, dan is de enige optie soms om te amputeren. Het is een traaggroeiende, maar zeer invasieve tumor waar eigenlijk nog geen doeltreffende therapie voor bestaat.”
Eiwit blokkeren
"Gebruikmakend van de CRISPR-technologie (techniek waarbij ingegrepen wordt in DNA, nvdr.) in Afrikaanse klauwkikkers (Xenopus), deden we een ontdekking over de groei van desmoïde tumoren. Die tumoren ontstaan door een heel specifieke mutatie. Nu blijkt dat ze geen kans krijgen om te groeien als een ander specifiek gen in het DNA wordt uitgeschakeld. Dat gen draagt specifieke informatie voor een eiwit (het enzyme EZH2), waaraan de cellen van de tumor als het ware verslaafd zijn. Zo weten we precies welk eiwit we moeten viseren om de groei van de desmoïde tumor tegen te gaan. Het goede nieuws is: er bestaat al een medicijn dat de activiteit van dat specifieke eiwit kan blokkeren.”

De drug, Tazemetostat (Tazverik), wordt nu al gebruikt bij patiënten met een andere soort kanker. “We hebben het effect van het medicijn onderzocht bij kikkers met een desmoïde tumor. Na drie weken waren de tumoren aanzienlijk gekrompen. Helemaal verdwijnen doen ze voorlopig niet, maar de resultaten zijn heel hoopgevend voor het verkleinen van de tumor zodat die minder schade kan aanrichten.”
Drug repurposed
Dat het medicijn al in de kliniek wordt gebruikt bij de behandeling van een andere kanker, heeft als gevolg dat het onmiddellijk ook getest kan worden bij patiënten met desmoïde tumoren. “We moeten voorzichtig zijn, want de klinische testen moeten nog starten. Maar we kunnen wel meteen enkele stappen overslaan omdat de drug al getest is op zaken zoals dosering en ongewenste bijwerkingen. Als alles goed loopt, kan het medicijn misschien al over een jaar of drie gebruikt worden. Al blijft voorspellen altijd moeilijk.”
De drug kan trouwens ook potentieel mogelijkheden bieden voor de behandeling van andere kankers. “De mutaties in de genen die deze desmoïde tumor veroorzaken, zien we ook bij meer dan 80 procent van de dikkedarmkankers. Hoewel die kankers veel complexer zijn en veel meer mutaties bevatten, lijkt het me logisch dat we onderzoeken of de drug daar een effect kan hebben.”
Mechanismen van het immuunsysteem
De volgende stap is achterhalen wat het mechanisme achter de werking van het medicijn is.
“We weten nu dat de drug werkt tegen desmoïde tumoren, maar we willen ook echt begrijpen
hoe dat precies komt. Weten waarom de tumoren niet kunnen groeien, kan ons nieuwe
inzichten geven”, legt professor Vleminckx uit. “Zo kan het zijn dat het medicijn een soort van
reactie van ons eigen immuunsysteem uitlokt. Maar dat weten we eigenlijk nog niet. Dat is
werk voor de komende jaren.”

Via het CRIG engageren onderzoekers zich om samen de medische uitdagingen van de toekomst in de behandeling van kanker het hoofd te bieden. Daarbij ligt de focus voornamelijk op toponderzoek dat kan leiden tot meer effectieve behandelingen en tot langere en betere overleving.
Lees ook
Biedt stoelgang een behandeling voor parkinson?
Een recente studie naar de ziekte van Parkinson toont aan dat een stoelgangtransplantatie een waardevolle nieuwe behandeling kan zijn. “Het biedt een potentieel veilige, doeltreffende en kostenefficiënte manier om de symptomen en de levenskwaliteit van miljoenen mensen te verbeteren. Een ‘bacteriepil’ zou de stoelgangtransplantatie misschien wel vervangen. Maar er is meer onderzoek nodig.”
Onderzoeker strijdt tegen vervelende bijwerking van borstkankerbehandeling met innovatieve contrastvloeistof
1 op de 9 vrouwen in België krijgt borstkanker. De behandeling gaat vaak gepaard met de inspuiting van een radioactieve vloeistof en blauwe kleurstof waarvan de borst jarenlang blauw kan kleuren. Om dat te vermijden werkt UGent-onderzoeker Loren Deblock aan een nieuwe contrastvloeistof gemaakt van… nanokristallen.
Dierenartsen op zoek naar betere griepvaccins voor de mens
De jaarlijkse griepprik is niet altijd even doeltreffend en daarom is de medische wereld al lang op zoek naar een griepvaccin dat een bredere bescherming biedt. Ook aan de faculteit Diergeneeskunde wordt meegezocht.
Erfenis voor meer vrouwelijke wetenschappers
Vrouwen ontwikkelen en ontdekken al eeuwen baanbrekende dingen. Toch krijgen zij daar amper erkenning voor. Dat moet anders, vond een anonieme vrouwelijke wetenschapper. Ze schonk een deel van haar erfenis aan de onderzoeksgroep van professor Frank Verstraete met als doel vernieuwend onderzoek door vrouwen te stimuleren.